Второй диплом из вторничного цикла публикаций дипломов по сельскому хозяйству. Тема диплома: Создание вектора, несущего репортерный ген β-глюкуронидазы GUS и оптимизация транзиентной экспрессии генно-инженерной конструкции в модельной системе растительных протопластов Nicotiana tabacum L

В настоящее время весьма актуальными становятся проблемы загрязнения окружающей среды различными поллютантами, в частности углеводородами нефти, тяжелыми металлами, а также радионуклидами, которые характеризуются длительным периодом полураспада, высоким токсикогенным и канцерогенным эффектом.
В связи с этим стремительно развивается перспективное направление биоаккумуляции поллютантов - фиторемедиация.
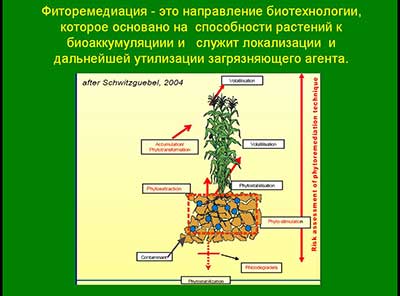
Фиторемедиация - это направление биотехнологии, которое, используя аккумулятивные свойства растений, служит локализации (путем извлечения из окружающей среды) и дальнейшей утилизации загрязняющего агента.
Целью данной работы явилось создание оптимально экспрессирующейся генно-инженерной конструкции, несущей репортерный ген β-глюкуронидазы (GUS-ген) и оценка транзиентной экспрессии этого гена в протопластах растений табака Nicotiana tabacum сорта Petit Havana.

В связи с данной целью работы были поставлены следующие задачи:
1) получение жизнеспособных протопластов табака Nicotiana tabacum, сорт Petit Havana;
2) создание генно - инженерных конструкций с геном gus под контролем 35S и RBC/O промоторов;
3) разработка системы клонирования созданных генно-инженерных конструкций;
4) подбор условий трансформации протопластов созданными конструкциями;
5) оценка транзиентной экспрессии гена GUS.
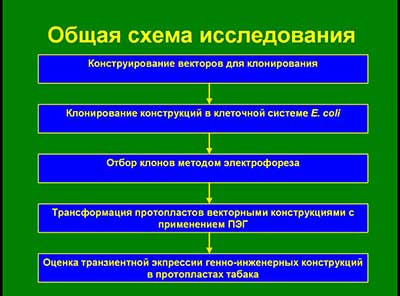
Общая схема исследования:
Конструирование векторов для клонирования
Клонирование конструкций в клеточной системе E. coli
Отбор клонов методом электрофореза
Трансформация протопластов векторными конструкциями с применением ПЭГ
Оценка транзиентной экпрессии генно-инженерных конструкций в протопластах табака
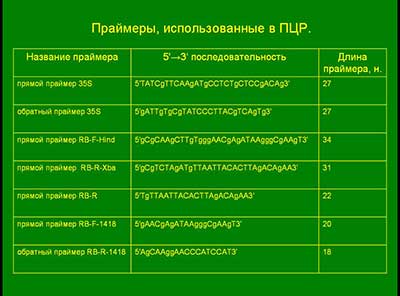
При постановке ПЦР использовали праймеры производства НПФ «ЛИТЕХ»
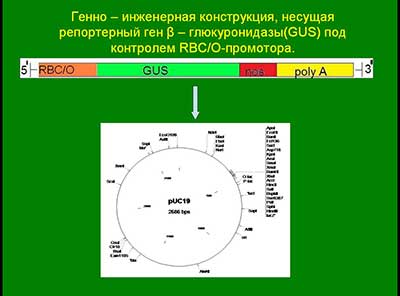
Генно – инженерная конструкция, несущая репортерный ген β-глюкуронидазы (GUS) под контролем 35SCaMV промотора
Для того чтобы из плазмиды создать оптимальный вектор для клонирования, необходимо учесть ряд требований:
1. конструкция должна нести селективный маркер (или несколько маркеров), что дает возможность легко идентифицировать клоны трансформантов и селективно поддерживать плазмиду в популяции бактериальных клеток;
2. конструкция должна содержать полилинкер (множественный сайт рестрикции);
3. конструкция должна быть относительно небольшой и желательно иметь ослабленный контроль репликации, что приводит к многокопийности исследуемого фрагмента ДНК в геноме, упрощает процедуру выделения ДНК и позволяет иметь высокую дозу клонированного гена;
4. конструкция должна стабильно поддерживаться в клетках-реципиентах.
Отбирают клоны двумя способами: 1) негативным отбором (нетрансфецированные клетки, в которых нет вектора, погибают), 2) при помощи изопропилтиогалактопиранозида, в случае, если клонированный ген находится под контролем системы lac-репрессор- lac-промотор (бело-голубая селекция).

Генно-инженерная конструкция, несущая репортерный ген β-глюкуронидазы (GUS) под контролем RBC/O-промотора
Электрофорез последовательности гена GUS, проведенный для оптимизации температуры отжига праймеров в процессе ПЦР

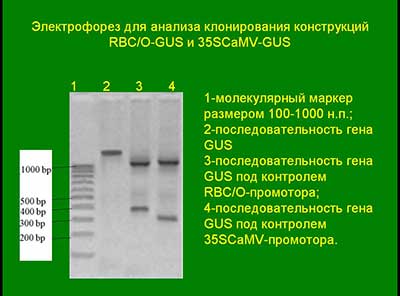
Электрофорез для анализа клонирования конструкций RBC/O-GUS и 35SCaMV-GUS
ПЦР ставили для обнаружения встраивания промоторов 35S GUS и RBC/O в создаваемые векторы, для обнаружения сделанных конструкций после клонирования в E.coli и оценки эффективности промоторов, разделяя их по молекулярной массе при электрофорезе.
Факторы, влияющие на трансформацию растительных протопластов Nicotiana tabacum L.
Тип и длина промотора, под контролем которого находится исследуемый фрагмент ДНК;наличие инициирующего кодона ATG, который индуцирует трансляцию репортерного белка;молекулярная масса, концентрация раствора и время экспозиции ПЭГ, который перераспределяет электрический заряд на плазмалемме, вследствие чего молекула встраиваемой ДНК и плазмалемма приобретают разноименный заряд, и фрагмент ДНК протягивается через пору в клетку;присутствие осмопротектора, который изменяет осмотический потенциал клетки.

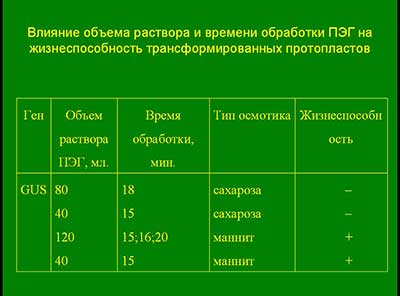
Влияние объема раствора и времени обработки ПЭГ на жизнеспособность трансформированных протопластов
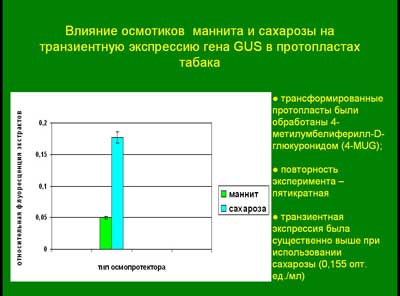
Влияние осмотиков маннита и сахарозы на транзиентную экспрессию гена GUS в протопластах табака
трансформированные протопласты были обработаны 4-метилумбелиферилл-D-глюкуронидом (4-MUG);повторность эксперимента – пятикратнаятранзиентная экспрессия была существенно выше при использовании сахарозы (0,155 опт. ед./мл)
Выводы и предложения
Была получена генно-инженерная конструкция pUC 19 35S CaMV-GUS, которая давала высокую транзиентную экспрессию в модельной системе растительных протопластов Nicotiana tabacum L.
Был оптимизирован метод ПЦР для одновременного анализа экспрессибельности конститутивного 35S CaMV промотора и тканеспецифичного RBC/O-промотора.
Был проведен сравнительный анализ экспрессибельности конститутивного 35S CaMV и тканеспецифичного RBC/O-промоторов, который показал целесообразность применения 35S CaMV промотора для получения высокого уровня экспрессии конструкции, в состав которой будет входить целевой ген цитохромоксидазы С1.

Был оптимизирован метод трансформации протопластов : определена наилучшая концентрация и время экспозиции ПЭГ, тип и концентрация осмопротектора, при которых были получены жизнеспособные трансформированные протопласты.
Для поддержания культуры трансформированных протопластов рекомендуется использовать в качестве осмопротектора маннит, для получения высокой транзиентной экспрессии конструкции в протопластах – сахарозу.

Полный бредотекст диплома прилагается.


